chimica
Le leggi della stechiometria descrivono la composizione delle diverse sostanze, in base alle relazioni (in massa) tra ogni specie che interviene nella reazione. Tutta la materia esistente è formata dalla combinazione, in diverse proporzioni, dei diversi elementi chimici che compongono la tavola periodica.
L'etanamide è una sostanza chimica che appartiene al gruppo di composti organici dell'azoto. Riceve anche il nome di acetamide, secondo l'Unione internazionale di chimica pura e applicata (IUPAC per il suo acronimo in inglese). Commercialmente è chiamato acido acetico. Si chiama ammide perché l'azoto è collegato a un gruppo carbonile. È
La reazione di Maillard è il nome dato alle reazioni chimiche tra aminoacidi e zuccheri riducenti che oscurano il cibo durante la tostatura, la cottura, la torrefazione e la frittura. I composti marroni si formano responsabili per il colore e l'aroma di prodotti come la crosta di pane, il roast beef, le patatine fritte e i biscotti cotti al forno.
Il cloruro di alluminio o il tricloruro di alluminio (AlCl 3 ) è un sale binario formato da alluminio e cloro. A volte appare come una polvere gialla perché ha impurità dovute alla presenza di ferro (III) cloruro. Si ottiene combinando i suoi elementi. L'alluminio, che ha tre elettroni nel suo ultimo livello di energia (famiglia IIIA), tende a cederli a causa del suo carattere metallico. I
L' acido carbossilico è un termine attribuito a qualsiasi composto organico che contiene un gruppo carbossile. Possono anche essere indicati come acidi organici e sono presenti in molte fonti naturali. Ad esempio, l'acido formico, un acido carbossilico, viene distillato da formiche e altri insetti come il coleottero galerita.
L'acido alendronico è un composto organico che appartiene alla classificazione dei bifosfonati, in particolare quelli della seconda generazione; Questi sono quelli che contengono atomi di azoto. Questo composto, così come il resto dei bifosfonati, ha un'alta analogia strutturale con il pirofosfato inorganico (PPi).
Acido formico o acido metanoico È il composto più semplice e più piccolo di tutti gli acidi organici. È anche noto come acido metanoico e la sua formula molecolare è HCOOH, con un solo atomo di idrogeno legato all'atomo di carbonio. Il suo nome deriva dalla parola formica , che in latino significa ant. I n
L'acido tartarico è un composto organico la cui formula molecolare è COOH (CHOH) 2 COOH. Ha due gruppi carbossili; cioè, può rilasciare due protoni (H +). In altre parole, è un acido diprotico. Inoltre, può essere classificato come un acido alderico (zucchero acido) e un derivato dell'acido succinico. Il s
Cloruro di calcio (CaCl 2) È un sale inorganico composto da calcio, metallo alcalino-terroso e alogeno al cloro. In quel composto ci sono diverse interazioni elettrostatiche che definiscono l'aspetto esteriore dei suoi cristalli e il resto delle loro proprietà fisiche. Inoltre, è sempre accompagnato da molecole d'acqua, formando idrati di formule generali CaCl 2 · xH 2 O, con x = 0, 1, 2, 4 e 6. Qu
La reazione esotermica è un tipo di reazione chimica in cui si verifica un trasferimento di energia, principalmente sotto forma di rilascio di calore o luce. Il nome deriva dal prefisso greco exo , che significa "all'esterno"; e il termine "termico", che si riferisce al calore o alla temperatura.
Le soluzioni chimiche sono quelle che sono conosciute come miscele omogenee in chimica. Sono miscele stabili di due o più sostanze in cui una sostanza (chiamata soluto) si dissolve in un'altra (chiamata solvente). Le soluzioni adottano la fase del solvente nella miscela e possono esistere in fasi solide, liquide e gassose.
La pirolisi consiste in un processo di decomposizione termica in cui le sostanze di origine organica nella sua grande maggioranza sono sottoposte a temperature elevate in un mezzo inerte (senza la presenza di ossigeno). Quando la materia organica viene trattata mediante pirolisi, si ottengono i prodotti utilizzati in campo industriale
La termochimica è responsabile dello studio delle modifiche caloriche che vengono effettuate nelle reazioni tra due o più specie. È considerato una parte essenziale della termodinamica, che studia la trasformazione del calore e di altri tipi di energia per comprendere la direzione in cui si sviluppano i processi e come varia la loro energia. I
Il nitrato di potassio è un sale ternario composto da potassio, metallo alcalino e nitrato di ossoanione. La sua formula chimica è KNO 3 , il che significa che per ogni ione K + c'è uno ione NO 3 - che interagisce con esso. Pertanto, è un sale ionico e costituisce uno dei nitrati alcalini (LiNO 3 , NaNO 3 , RbNO 3 ...)
La difenilammina è un composto organico la cui formula chimica è (C 6 H 5 ) 2 NH. Il suo nome indica che è un'ammina, così come la sua formula (-NH 2 ). D'altra parte, il termine "difenile" si riferisce alla presenza di due anelli aromatici legati all'azoto. Di conseguenza, la difenilammina è un'ammina aromatica. All
Il cloruro di stronzio è un composto inorganico formato da stronzio, metallo alcalino-terroso (Mr. Becamgbara) e cloro alogeno. Poiché entrambi gli elementi hanno un'elettronegatività molto diversa, il composto è un solido ionico la cui formula chimica è SrCl 2 . Essendo un solido ionico, è costituito da ioni. Per
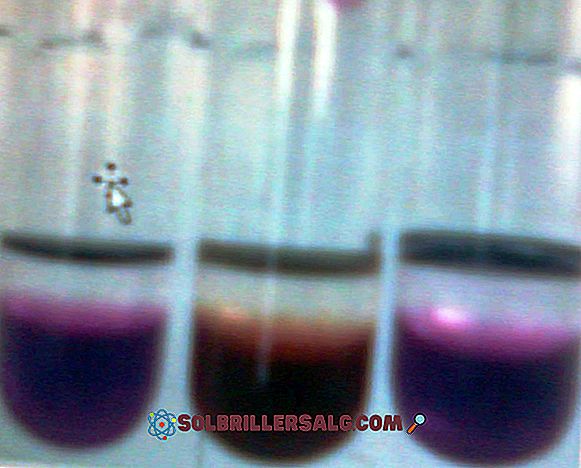
La fenolftaleina è un colorante organico, che a sua volta è un acido diprotico debole, utilizzato in molte determinazioni volumetriche come indicatore acido-base. Cioè, se è un acido diprotico, in soluzione può perdere due ioni H +, e per essere un indicatore deve avere la proprietà di essere colorato nell'intervallo di pH che si sta valutando. Nel
Permanganato di potassio (KMnO 4) è un composto inorganico formato da manganese - gruppo di metalli di transizione 7 (VIIB) -, ossigeno e potassio. È un solido vitreo viola scuro. Le loro soluzioni acquose sono anche viola scuro; Queste soluzioni diventano meno violente in quanto vengono diluite in quantità maggiori di acqua. I
L'ossido di stronzio , la cui formula chimica è SrO (da non confondere con il perossido di stronzio, che è SrO2), è il prodotto della reazione ossidativa tra questo metallo e l'ossigeno presente nell'aria a temperatura ambiente: 2Sr (s) + O2 (g) → 2SrO (s). Un pezzo di stronzio brucia a contatto con l'aria come conseguenza della sua alta reattività, e poiché ha una configurazione elettronica del tipo ns2, produce prontamente i suoi due elettroni di valenza, specialmente la molecola biatomica di ossigeno. Se la
L' elettrone differenziale o differenziante è l'ultimo elettrone posto nella sequenza della configurazione elettronica di un atomo. Perché è il suo nome? Per rispondere a questa domanda, è necessaria la struttura di base di un atomo: il suo nucleo, il vuoto e gli elettroni. Il nucleo è un aggregato denso e compatto di particelle positive chiamate protoni e di particelle neutre chiamate neutroni. I p
L'idrossiapatite è un minerale di fosfato di calcio, la cui formula chimica è Ca 10 (PO 4 ) 6 (OH) 2 . Insieme ad altri minerali e materiale organico rimane schiacciato e compattato, forma la materia prima conosciuta come roccia fosforica. Il termine "idrossi" si riferisce all'Onione.
Il fosfato di magnesio è un termine usato per riferirsi a una famiglia di composti inorganici formati da magnesio, metallo alcalino-terroso e fosfato d'argento. Il fosfato di magnesio più semplice ha la formula chimica Mg 3 (PO 4 ) 2 . La formula indica che per ogni due anioni PO 4 3- ci sono tre cationi Mg2 + che interagiscono con questi.
Il vetro Pyrex è uno speciale vetro borosilicato il cui marchio (Pyrex) ha fatto la sua apparizione nella città di New York nel 1915, prodotto da Corning Glass. È emerso come materiale per il moderno packaging alimentare, utilizzato anche per conservare e cuocere il cibo nello stesso tipo di contenitore. L
Gli enantiomeri sono quelle coppie di composti organici (e inorganici) che consistono in due immagini speculari che non possono sovrapporsi l'una sull'altra. Quando accade il contrario - ad esempio, nel caso di una palla, una mazza da golf o una forchetta - si dice che siano oggetti achirali
I metalli non ferrosi sono tutti quelli che mancano o hanno quantità trascurabili di ferro. Questi, in diverse proporzioni di massa, sono utilizzati per la creazione di leghe che presentano proprietà fisiche migliori rispetto ai singoli metalli. Pertanto, le sue strutture cristalline e le interazioni metalliche sono la pietra angolare delle applicazioni delle leghe non ferrose.
Precipitazione o precipitazione chimica è un processo che consiste nella formazione di un solido insolubile dalla miscela di due soluzioni omogenee. A differenza delle precipitazioni di pioggia e neve, in questo tipo di precipitazioni "piove a dirotto" dalla superficie del liquido. In due soluzioni omogenee, gli ioni sono disciolti in acqua.
Il carattere metallico degli elementi della tavola periodica si riferisce a tutte quelle variabili, chimiche e fisiche, che definiscono i metalli o li distinguono dalle altre sostanze naturali. Sono generalmente solidi, densi, duri, con elevate conducibilità termiche ed elettriche, modellabili e duttili.
I sali di diazonio sono composti organici in cui sono presenti interazioni ioniche tra il gruppo azo (-N 2 +) e un anione X- (Cl-, F-, CH 3 COO-, ecc.). La sua formula chimica generale è RN 2 + X-, e in questo la catena laterale R può essere un gruppo alifatico o un gruppo arile; cioè, un anello aromatico. L
I metalli ferrosi sono quelli che contengono ferro (Fe), così come piccole quantità di altri metalli che vengono aggiunti per dare certe proprietà benefiche alle loro leghe. Sebbene il ferro possa esistere in vari stati di ossidazione, +2 (ferroso) e +3 (ferrico) sono i più comuni. Tuttavia, il termine "ferroso" si riferisce alla presenza di ferro indipendentemente dal suo stato di ossidazione nel materiale. Il
La teoria delle bande è quella che definisce la struttura elettronica del solido nel suo insieme. Può essere applicato a qualsiasi tipo di solido, ma è nei metalli in cui si riflettono i suoi più grandi successi. Secondo questa teoria, il legame metallico risulta dall'attrazione elettrostatica tra gli ioni caricati positivamente e gli elettroni mobili nel cristallo. Pe